Kendric Cromer, um menino de 12 anos de um subúrbio de Washington, recentemente tornou-se a primeira pessoa no mundo com doença falciforme a iniciar uma terapia genética comercialmente aprovada que tem potencial para curar a condição.
Para as cerca de 20 mil pessoas com esse tipo de anemia nos Estados Unidos que se qualificam para o tratamento, o início da jornada médica de vários meses de Kendric pode oferecer esperança. Mas também sinaliza as dificuldades que os pacientes enfrentam ao buscar novos tratamentos para essa condição.
Para alguns poucos sortudos, como Kendric, o tratamento pode tornar possíveis vidas que eles sempre desejaram. Um adolescente solene e tímido, ele aprendeu que atividades comuns — andar de bicicleta, sair em um dia frio, jogar futebol — poderiam desencadear episódios de dor intensa.
“A doença falciforme sempre rouba meus sonhos e interrompe todas as coisas que quero fazer”, ele disse. Agora, ele sente que tem uma chance de ter uma vida normal.
Perto do final do ano passado, a FDA (Food and Drug Administration), agência federal norte-americana, concedeu a duas empresas autorização para vender terapia genética para pessoas com essa condição— um distúrbio genético dos glóbulos vermelhos que causa dor debilitante e outros problemas médicos.
Estima-se que 100 mil pessoas nos Estados Unidos sejam afetadas pela doença, a maioria delas negra. Indivíduos nascem com essa patologia quando herdam o gene mutado de ambos os pais.
O tratamento ajudou pacientes em ensaios clínicos, mas Kendric é o primeiro paciente comercial da Bluebird Bio, uma empresa de Somerville, Massachusetts.
Outra empresa, a Vertex Therapeutics de Boston, recusou-se a dizer se havia iniciado o tratamento para algum paciente com seu remédio aprovado baseado na edição de genes Crispr (Clustered Regularly Interspaced Short Palindromic Repeats, na tradução livre para o português, repetições palindrômicas curtas e agrupadas regularmente interespaçadas)— é uma tecnologia revolucionária de edição de genes que permite aos cientistas modificar o DNA de organismos de maneira precisa e eficiente.
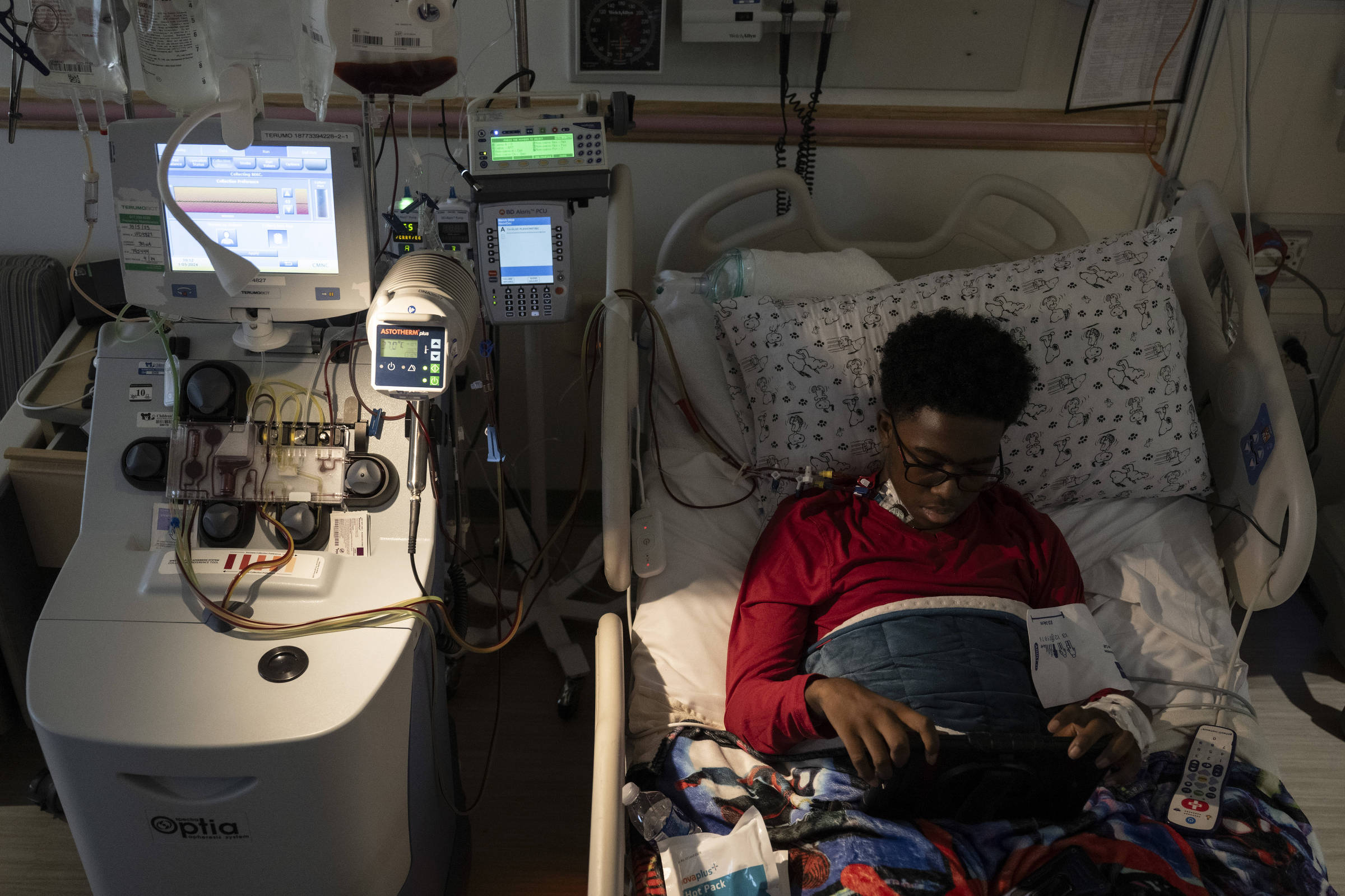
Kendric — cujo seguro de saúde da família concordou em cobrir o procedimento — começou seu tratamento no Children’s National Hospital, em Washington. O tratamento, realizado na última quarta-feira (1º), foi apenas o primeiro passo.
Os médicos removeram suas células-tronco da medula óssea, que a Bluebird modificará geneticamente em um laboratório especializado para seu tratamento, que levará meses. Mas antes de começar, a Bluebird precisa de centenas de milhões de células-tronco de Kendric, e se a primeira coleta — que leva de seis a oito horas — não for suficiente, a empresa tentará mais uma ou duas vezes.
Se ainda não tiver o suficiente, Kendric terá que passar mais um mês em preparação para outra extração de células-tronco.
Todo o processo é tão envolvente e demorado que a Bluebird estima que pode tratar as células de apenas 85 a 105 pacientes por ano — e isso inclui não apenas pacientes com doença falciforme, mas também pacientes com uma doença muito mais rara — talassemia beta — que podem receber uma terapia genética semelhante.
Os centros médicos também têm capacidade para tratar apenas um número limitado de pacientes de terapia genética. Cada pessoa precisa de cuidados especializados e intensivos. Depois que as células-tronco do paciente são tratadas, ele tem que ficar no hospital por um mês. Durante a maior parte desse tempo, os pacientes ficam gravemente doentes devido à quimioterapia poderosa.
O Children’s National Hospital pode aceitar apenas cerca de 10 pacientes de terapia genética por ano.
“É um grande esforço”, disse o médico David Jacobsohn, chefe da divisão de transplante de sangue e medula do centro médico.
Topo da Lista de Espera
Na semana passada, Kendric se preparou para a coleta de células-tronco — ele passou muitas semanas neste hospital sendo tratado por dores tão severas que, em sua última visita, nem mesmo morfina e oxicodona podiam controlá-las.
Ele trouxe seu travesseiro especial com uma fronha do Snoopy que sua avó lhe deu e seu cobertor especial do Homem-Aranha e ele tinha um objetivo. “Quero ser curado”, disse ele.
Células-tronco da medula óssea, a fonte de todos os glóbulos vermelhos e brancos do corpo, normalmente estão aninhadas na medula óssea de uma pessoa. Mas os médicos de Kendric o infundiram com um medicamento, plerixafor (medicamento usado para mobilizar células-tronco do sangue da medula óssea para a corrente sanguínea), que as desprendeu e as deixou flutuar em seu sistema circulatório.
Para isolar as células-tronco, membros da equipe do hospital inseriram um cateter em uma veia no peito de Kendric e o conectaram a uma máquina de aférese, um dispositivo em forma de caixa ao lado de sua cama de hospital. Ele gira o sangue, separando-o em camadas — uma camada de plasma, uma camada de células vermelhas e uma camada de células-tronco.
Depois que células-tronco suficientes forem coletadas, elas serão enviadas ao laboratório da Bluebird em Allendale, Nova Jersey, onde técnicos adicionarão um gene de hemoglobina saudável para corrigir os mutados que estão causando a doença falciforme de Kendric. Três meses depois, as células modificadas serão devolvidas.
O objetivo é fornecer a Kendric glóbulos vermelhos que não se transformem em formas frágeis de crescente e fiquem presos em seus vasos sanguíneos e órgãos. Embora leve apenas alguns dias para adicionar um novo gene às células-tronco, são necessárias semanas para completar testes de pureza, potência e segurança. Os técnicos têm que cultivar as células no laboratório antes de fazer esses testes.
A Bluebird lista um preço de US$ 3,1 milhões (cerca de R$ 15,7 milhões) para sua terapia genética, chamada Lyfgenia, um dos preços mais altos já estabelecidos para um tratamento. Apesar do preço astronômico e do processo árduo, os centros médicos têm listas de espera de pacientes esperando por alívio de uma doença que pode causar derrames, danos aos órgãos, danos ósseos, episódios de dor agonizante e vidas encurtadas.
No Children’s National, o médico Jacobsohn afirma que, pelo menos, 20 pacientes eram elegíveis e interessados. A escolha de quem iria primeiro dependeu de quem estava mais doente e de quem teve o seguro aprovado. Kendric se qualificou nos dois aspectos.
Mas, embora seu seguro tenha aprovado rapidamente o tratamento, os pagamentos do seguro são apenas parte do que custará à sua família.
Há sempre uma esperança
Deborah Cromer, corretora de imóveis, e seu marido, Keith, que trabalha na aplicação da lei para o governo federal, não tinham ideia de que poderiam ter um filho com doença falciforme. Eles descobriram apenas quando Deborah estava grávida de Kendric.
Os testes mostraram que o bebê teria uma chance em quatro de herdar o gene mutado de cada pai e ter a doença falciforme. Eles poderiam interromper a gravidez ou arriscar. Eles decidiram arriscar. A notícia de que Kendric tinha a condição foi devastadora. Ele teve sua primeira crise quando tinha 3 anos.
Células sanguíneas falciformes ficaram presas em suas pernas e pés. O bebê estava inconsolável, com tanta dor que Deborah nem conseguia tocá-lo. Eventualmente, a doença começou a causar danos severos. Kendric desenvolveu necrose avascular nos quadris — morte óssea que ocorre quando o osso é privado de sangue.
A doença se espalhou para as costas e ombros, e ele começou a tomar uma forte dose diária de gabapentina, um medicamento para dor nervosa. Sua dor nunca diminuium dia ele disse à Deborah, “Mamãe, sinto dor todos os dias.”
Deborah e Keith começaram a ter esperança na terapia genética. Mas quando descobriram quanto custaria, perderam parte dessa esperança. Mas o seguro deles aprovou o tratamento em algumas semanas, disseram. Agora começou. “Sempre rezamos para que esse dia chegasse”, disse Deborah.
Mas, ela acrescentou: “estamos nervosos lendo os consentimentos e o que ele terá que enfrentar.” Kendric, no entanto, está ansioso pelo futuro. Ele quer ser geneticista e disse: “quero jogar basquete.”