Em 2021, quase 2.000 voluntários responderam ao chamado para testar um medicamento experimental para Alzheimer conhecido como BAN2401. Para a fabricante Eisai, o teste era uma chance de um grande lucro —potencialmente bilhões de dólares— por desarmar uma doença que confundiu pesquisadores por mais de um século.
Para avaliar a eficácia e segurança do medicamento, a Eisai procurou incluir pessoas cujos perfis genéticos as tornavam especialmente propensas a desenvolver Alzheimer. Mas essas mesmas pessoas também eram mais vulneráveis a hemorragias ou inchaços cerebrais se recebessem o medicamento.
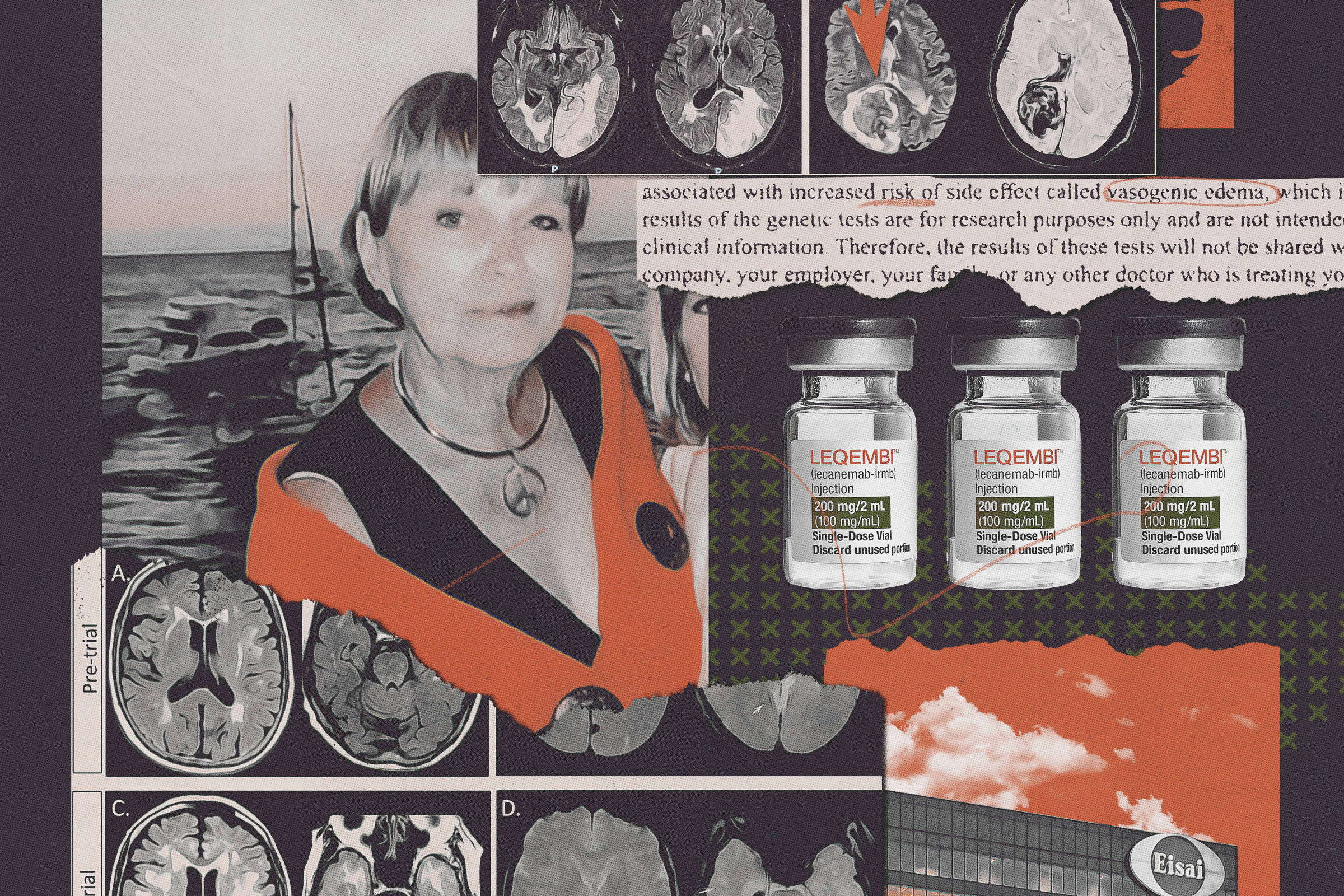
Para identificar esses voluntários de alto risco, a Eisai informou a todos que fariam um teste genético. Mas os resultados, acrescentou a empresa, permaneceriam em segredo.
Ao todo, 274 voluntários participaram do teste sem que a Eisai lhes dissesse que estavam em risco especialmente alto de lesões cerebrais, mostram documentos obtidos pelo The New York Times.
Uma delas foi Genevieve Lane, uma residente de 79 anos de Villages, na Flórida, que morreu em setembro de 2022 após três doses do medicamento, com seu cérebro repleto de 51 micro-hemorragias. Uma autópsia determinou que os efeitos colaterais do medicamento contribuíram para sua morte. Em suas últimas horas de vida se debatia tão violentamente que as enfermeiras tiveram que amarrá-la.
Outro voluntário de alto risco do teste morreu, e mais de 100 outros sofreram hemorragias ou inchaços cerebrais. Embora a maioria dessas lesões tenha sido leve e assintomática, algumas foram graves e ameaçadoras à vida.
“Este é um medicamento que tem alguns efeitos colaterais significativos, e precisamos estar cientes deles”, diz Matthew Schrag, neurologista da Universidade Vanderbilt que ajudou na autópsia de Lane.
No início do ano passado, a FDA (Food and Drug Administration, agência reguladora americana) aprovou o medicamento para Alzheimer da Eisai, comercializado como Leqembi, dizendo que seu benefício modesto —uma leve desaceleração do declínio cognitivo por alguns meses— superava seus riscos.
Em julho passado, a agência aprovou um segundo medicamento semelhante, o Kisunla. Em um teste clínico, seu fabricante, Eli Lilly, também optou por não informar 289 voluntários de que seus perfis genéticos os tornavam vulneráveis a lesões cerebrais, descobriu o Times. Dezenas experimentaram o que a Lilly classificou como hemorragias cerebrais “graves”.
Os testes de medicamentos são em parte projetados para esclarecer riscos, razão pela qual os voluntários são rotineiramente informados dos perigos potenciais antes de participar. Nos testes do Leqembi e do Kisunla, os voluntários primeiro tiveram que assinar formulários de consentimento que diziam que pessoas com certos perfis genéticos enfrentavam riscos mais altos de lesões cerebrais ao receber os medicamentos e que os participantes seriam testados para eles —mas não informados dos resultados.
As empresas minaram o princípio do consentimento informado, dizem especialistas.
George Perry, editor do Journal of Alzheimer’s Disease, considera que a decisão de não divulgar os resultados é “certamente preocupante” e “eticamente complicada”. Perry acrescenta, assim como vários outros especialistas, que desconhecia cláusulas de não divulgação semelhantes em outros testes recentes.
As cláusulas de sigilo, que não foram previamente relatadas, vieram à tona enquanto o Times investigava como a longa e cara busca por um tratamento eficaz para Alzheimer levou ao teste e aprovação do Leqembi (e subsequentemente do Kisunla). Repórteres revisaram testes clínicos, registros de pacientes e relatórios de lesões e entrevistaram pesquisadores, neurologistas, participantes de testes, famílias de pacientes com Alzheimer, representantes da indústria farmacêutica e funcionários da FDA.
Leqembi e Kisunla buscam remover uma proteína deformada chamada beta amiloide que forma placas nos cérebros de pacientes com Alzheimer. Em grande medida, os medicamentos tiveram sucesso —um notável feito científico.
No entanto, os remédios não interrompem o declínio cognitivo nem revertem os danos cerebrais. Leqembi desacelera o declínio por cerca de cinco meses, enquanto Kisunla alcança um atraso ligeiramente maior. A evidência de seu benefício limitado contribuiu para uma crescente percepção de que a teoria dominante do Alzheimer —de que faixas pegajosas de amiloide desencadeiam uma cascata de eventos tóxicos que levam à doença— é, na melhor das hipóteses, incompleta e talvez errada.
Ao mesmo tempo, muitos especialistas em Alzheimer se preocupam que os riscos dos novos medicamentos não tenham sido totalmente apreciados nem compreendidos, especialmente quando comparados ao seu benefício modesto.
“As pessoas que estão no comando do teste clínico não enfrentaram a gravidade da toxicidade” do Leqembi, diz Rudolph J. Castellani, professor de patologia na Feinberg School of Medicine da Northwestern em Chicago. Castellani realizou uma autópsia em Jean Terrien, o outro voluntário de alto risco que morreu durante o teste do Leqembi.
Em julho, a regulação de medicamentos da União Europeia foi contra a aprovação do Leqembi, co-comercializado pela Biogen. Na semana passada, a da Austrália também recusou aprovar o medicamento. Ambas as agências disseram que o atraso temporário no declínio cognitivo do medicamento não superava os riscos de segurança. Nos Estados Unidos, uma conclusão semelhante foi alcançada pelo Instituto de Revisão Clínica e Econômica, um grupo independente amplamente utilizado de analistas.
Além disso, uma nova análise de nove pesquisadores líderes sugere que pacientes tomando Leqembi e um medicamento anti-amiloide anterior, Aduhelm, tiveram uma taxa de mortalidade mais alta do que uma população de pacientes com Alzheimer não tratados de idade semelhante nos Estados Unidos.
A preocupação com lesões cerebrais tem permeado anos de testes de medicamentos amiloides. Em 2010, a FDA recomendou o endurecimento dos protocolos para proteger os sujeitos mais vulneráveis. Mas os pesquisadores resistiram, e quando argumentaram por ampliar a elegibilidade, o regulador federal concordou.
Para o estudo do Leqembi, a cláusula de sigilo foi aprovada por um conselho de revisão institucional administrado por uma empresa apoiada por private equity, a Advarra. Sob a lei federal, esses conselhos são encarregados de garantir que os participantes dos testes não enfrentem riscos desnecessários e sejam informados dos riscos dos estudos.
Enquanto o teste do Leqembi estava em andamento, a Advarra publicou uma “folha de dicas” online chamando o consentimento informado de “uma das proteções centrais” para os sujeitos de pesquisa. Quando questionado pelo Times sobre a aprovação da cláusula de sigilo no teste do Leqembi pela Advarra, um porta-voz da empresa disse que não podia fornecer respostas.
A Eisai cancelou uma entrevista e não respondeu a mensagens repetidas ao longo de vários meses buscando uma explicação para sua decisão de não divulgar os achados genéticos.
Mas um investigador do teste do Kisunla, David Weidman, concordou em discutir a cláusula de não divulgação da Lilly. Ele apontou para pesquisas que mostram que participantes de testes informados sobre seus perfis genéticos podem distorcer suas autoavaliações de progresso.
Weidman não projetou o teste, no entanto, e disse que, em retrospecto, acreditava que preocupações bioéticas poderiam ter desempenhado um papel maior. “O lado ético supera o lado científico? Pessoalmente, eu diria que sim”, diz Weidman, neurologista afiliado ao Banner Alzheimer’s Institute em Phoenix.
A Lilly emitiu uma declaração dizendo que deu aos participantes a opção de conhecer seus perfis genéticos, mas apenas após o término do teste. “Nosso conselho é que os participantes assumam que têm o risco mais alto” desde o início, diz John Sims, neurologista da Lilly que supervisionou o estudo.
Em um estudo subsequente de seu medicamento, no entanto, a empresa deu aos voluntários a opção de conhecer seus resultados de teste antes de entrar no teste.
A Eisai, em declarações públicas sobre o Leqembi, citou descobertas de testes que indicam que inchaços e hemorragias cerebrais graves são raros e, na maioria das vezes, assintomáticos.
E muitos pesquisadores argumentam que o risco de efeitos colaterais é um pequeno preço a pagar por desacelerar, mesmo que temporariamente, uma doença devastadora que aflige quase 7 milhões de americanos.
“As pessoas são roubadas de tudo o que nos torna humanos”, diz Howard Fillit, professor da Icahn School of Medicine no Mount Sinai em Nova York e uma voz proeminente na pesquisa de Alzheimer. “Não conseguem se vestir. Não conseguem ir ao banheiro. Esquecem como andar. Esquecem como engolir. São como bebês em um corpo humano.”
‘A Esperança Começa Aqui’
Entre a região de cavalos da Flórida ao norte e a Disney World ao sul, há uma terra onde as pessoas buscam realizar seus sonhos antes de morrer. Para a indústria farmacêutica, esta colônia, os Villages, é um laboratório de corpos envelhecidos para estudar na esperança de criar medicamentos transformadores, com perspectiva de lucros quase inimagináveis.
Recrutar pessoas para testes com potenciais riscos à saúde requer habilidade e imaginação. A Charter Research realiza testes de medicamentos nos Villages em nome de empresas farmacêuticas, em parte assumindo o papel de conselheiro de acampamento, organizando uma agenda lotada de eventos diários —todos gratuitos.
Uma manhã, os residentes lotaram um cinema para uma sessão de filme, seguida por uma discussão sobre os estragos do Alzheimer. No dia seguinte, a Charter marcou presença no jornal local, com anúncios para um “Novo Teste de Memória em Casa” e “Triagens de Memória Gratuitas”.
Lane havia chegado aos Villages em 2014, juntando-se à sua amiga de longa data de Chicago, Vicki Holmes. Juntas, elas viajaram pelo mundo e navegaram por casamentos, conflitos mãe-filha e o espectro da velhice.
Antes de se aposentar, Lane havia sido vice-presidente de uma empresa de transporte. Agora, ela estava perdendo suas capacidades mentais. Mas Holmes a resgatava alegremente quando ela se perdia, ajudava a planejar suas atividades diárias e a levava ao mercado, cabeleireiro e salão de unhas.
Então, em 2020, Lane viu um anúncio da Charter buscando voluntários para um teste de um medicamento experimental para Alzheimer. Ela ficou animada. Talvez o teste pudesse ajudá-la e a outros, especialmente seus filhos, que poderiam um dia desenvolver a doença. Talvez esse medicamento pudesse torná-la menos frustrada, mais capaz de aproveitar a vida.
Como dizia o anúncio da Charter, “A Esperança Começa Aqui”. A Charter não podia prometer uma cura, apenas a esperança que vinha com o medicamento conhecido como BAN2401.
Gerenciando o risco
Desde a década de 1990, os pesquisadores se concentraram em provar a “hipótese da cascata amiloide” e encontrar um tratamento que atacasse a proteína culpada. No entanto, teste após teste, tentar remover a amiloide produziu efeitos colaterais significativos.
O fracasso mais consequente envolveu um medicamento chamado bapineuzumab, conhecido como bapi. Analistas de Wall Street previram vendas anuais chegando a US$ 13 bilhões; uma revista médica proclamou que o futuro da pesquisa sobre Alzheimer “poderia depender do resultado do bapineuzumab”. Essas esperanças diminuíram em 2008, quando se descobriu que o bapi causava lesões cerebrais com pouca ou nenhuma melhora cognitiva.
Para proteger melhor os pacientes mais vulneráveis, a FDA recomendou que futuros testes excluíssem voluntários com histórico de micro-hemorragias, rupturas de pequenos vasos sanguíneos no cérebro. Na época, pessoas com uma ou duas micro-hemorragias anteriores eram aceitas.
Temendo que essa mudança prejudicasse indevidamente os esforços para estudar novos medicamentos amiloides, um grupo de pesquisadores proeminentes na conferência —maioria com laços estreitos com a indústria farmacêutica— planejou uma contraofensiva. O caminho a seguir estava em gerenciar o risco, não eliminá-lo.
“Precisamos ser menos avessos ao risco na doença de Alzheimer”, diria mais tarde Philip Scheltens, membro do grupo. “Devemos dosar cuidadosamente até que os efeitos colaterais nos digam para parar.”
No final, o grupo recomendou expandir a elegibilidade para as próprias pessoas que o governo esperava proteger. Agora, quatro micro-hemorragias seriam permitidas. A FDA cedeu, recebendo elogios por uma colaboração “exemplar” da Associação de Alzheimer, um grupo de defesa que aceita financiamento da indústria e organiza grandes conferências.
O grupo deu outro passo: rebatizou o nome das lesões cerebrais, em parte para fazê-las parecer menos assustadoras. Em vez de edema vasogênico e micro-hemorragias, a condição agora seria chamada pelo nome operático ARIA, um acrônimo para anormalidade de imagem relacionada à amiloide.
Mas se as novas diretrizes abriram o processo de teste, fizeram muito menos para concretizar a busca da indústria. Com o tempo, essa busca consumiu tanto dinheiro de pesquisa que se tornou “grande demais para falhar”, diz Perry, editor da revista e pesquisador de Alzheimer na Universidade do Texas em San Antonio.
Em junho de 2021, a FDA concedeu aprovação acelerada para o Aduhelm, o primeiro medicamento a tratar a suposta causa raiz do Alzheimer.
Prova de uma vitória. Conforme relatado em um editorial na revista médica JAMA, a aprovação do Aduhelm “gerou uma reação significativa devido à evidência pouco clara da eficácia clínica do medicamento”, efeitos adversos graves e um processo de aprovação que uma investigação do Congresso chamou de “cheio de irregularidades”. (Com vendas em declínio, a Biogen abandonou o medicamento em janeiro deste ano.)
A Eisai, no entanto, estava apostando suas esperanças no Leqembi.
Pacientes no escuro
Pesquisadores de 19 empresas farmacêuticas, biotecnológicas e médicas já haviam se reunido em um hotel no aeroporto de Phoenix para uma reunião altamente incomum. Embora concorrentes, os cientistas queriam colaborar em estratégias para a pesquisa de Alzheimer —especificamente, se medicamentos anti-amiloides poderiam prevenir o Alzheimer em pessoas que ainda estavam cognitivamente normais, antes do início do declínio.
Eles precisavam de sujeitos de teste com uma variante genética chamada APOE4 —pessoas com alta probabilidade genética de desenvolver Alzheimer. Pessoas com duas cópias da variante genética constituem cerca de 2% a 3% da população geral e 15% a 20% das pessoas com Alzheimer. Aqueles com apenas uma cópia representam cerca de metade dos pacientes.
Uma questão em Phoenix era como, ou mesmo se, esses sujeitos de teste deveriam ser informados de seus perfis genéticos sombrios, de acordo com um relato escrito na época da reunião.
“Pesquisadores infelizmente têm um conflito de interesse inerente”, diz Robert Klitzman, diretor do Programa de Mestrado em Bioética da Universidade de Columbia. “Eles querem que as pessoas participem de seu estudo, e há pesquisadores que sentem que, se eu contar às pessoas todos os fatos e riscos, elas podem não querer participar do estudo.”
Um consenso geral emergiu da reunião sobre a importância da transparência; os participantes seriam informados. Para lidar com essa notícia, eles primeiro passariam por aconselhamento genético.
Subsequentemente, duas empresas farmacêuticas, Novartis e Amgen, comprometeram-se a trabalhar para testar um medicamento experimental. O teste terminou abruptamente em 2019, após os participantes experimentarem um “agravamento em algumas medidas de função cognitiva”, de acordo com a Novartis.
A Eisai adotou uma abordagem diferente sobre a divulgação em seu estudo do Leqembi.
Em seu protocolo de teste, a empresa especificou que queria participantes já experimentando declínio cognitivo leve. “Não menos que 70%” teriam o gene APOE4. Sabe-se que os portadores enfrentam um risco maior de lesões cerebrais, especialmente aqueles com duas cópias.
Antes de ingressar no teste, todos os voluntários tinham que assinar um formulário de consentimento, que dizia que eles seriam testados para um perfil genético que significava um risco maior de anormalidades de sangramento devido ao medicamento, incluindo micro-hemorragias cerebrais e inchaço cerebral. Mas o formulário estipulava que os resultados dos testes eram “para fins de pesquisa” e “não serão compartilhados com você, qualquer companhia de seguros, seu empregador, sua família ou qualquer outro médico que esteja tratando você.”
No total, o teste inscreveu 957 pessoas com uma cópia do gene de risco e 274 com duas cópias.
Marwan Sabbagh, neurologista que aconselhou a Eisai sobre o Leqembi, chamou a divulgação de informações genéticas de “dependente do estudo”. “Cada estudo decide fazer isso de maneira um pouco diferente”, afirma ele.
Mas Arthur Caplan, bioeticista líder na Escola de Medicina Grossman da Universidade de Nova York, diz que os participantes do teste deveriam conhecer os perigos que enfrentam. “Não é nem uma questão de ética; é uma questão de bom senso”, afirma ele após o Times informá-lo sobre a cláusula de não divulgação.
Um porta-voz da FDA, Jeremy Kahn, não abordou as perguntas do Times sobre a adequação da cláusula de não divulgação, além de dizer que a agência havia revisado o protocolo do teste e determinado que era seguro.
Questionada sobre por que o conselho de revisão institucional da Advarra havia aprovado a decisão de manter os participantes no escuro, uma porta-voz da empresa, Mel Johnson, escreveu: “Receio que, neste momento, não vou conseguir obter respostas para você sobre isso.” Ela se recusou a explicar o motivo.
Lane estava entre aqueles no ensaio do Leqembi que carregavam duas cópias do APOE4. Ela também possuía outro fator de risco, aquele que preocupou a FDA quando propôs o endurecimento dos requisitos de elegibilidade em 2010.
Ela havia sofrido quatro micro-hemorragias anteriores, aumentando a probabilidade de sangramento cerebral ao tomar Leqembi. Os médicos da Eisai aparentemente não conseguiram identificá-las, mas Schrag, que auxiliou na autópsia de Lane, as encontrou ao examinar suas tomografias cerebrais pré-ensaio.
“Estou bastante confiante em nossa interpretação”, diz ele. “E publicamos essas tomografias para que as pessoas pudessem contestar nossas contagens se quisessem, e ninguém o fez.”
Desconhecendo seus riscos duplos, Lane chegou ao Charter Research dois dias antes do Natal de 2020 e assinou seu formulário de consentimento. Nos meses que se seguiram, ela recebeu apenas um placebo. Em 25 de julho de 2022, ela concordou em participar de uma nova fase do ensaio, na qual os pacientes poderiam optar por receber o medicamento. Em 8 de agosto, ela teve sua primeira infusão de Leqembi.
Avisos de caixa preta
Quase dois anos após a aprovação do Leqembi, várias grandes instituições de saúde optaram por não administrar o medicamento a ninguém com duas cópias do APOE4.
A introdução do medicamento foi dificultada por seu custo de US$26.500 por ano; sua eficácia limitada; e a necessidade de exames de ressonância magnética frequentes e caros. Mais de um terço dos neurologistas dos EUA não recomendam o Leqembi para pacientes com Alzheimer, de acordo com um relatório recente da Spherix Global Insights, uma empresa de pesquisa de mercado.
A FDA exigiu que a Eisai incluísse um aviso de caixa preta instando os médicos a considerarem os potenciais riscos do medicamento. A Eisai agora aconselha que “o teste para o status do APOE4 deve ser realizado antes do início do tratamento” e que os prescritores devem discutir os riscos de ARIA com os pacientes.
Na Associação de Alzheimer, a diretora científica, Maria C. Carrillo, acredita que para muitos pacientes, o Leqembi vale bem os riscos. “Não é uma cura. Entendemos isso. E tem efeitos colaterais. Então pode não ser para todos. Mas para aqueles que poderiam se beneficiar, oferece mais tempo durante a fase mais crítica em que você ainda é independente, ainda tem muitas oportunidades de aproveitar o tempo com a família, batizados, casamentos, formaturas.”
Vários especialistas entrevistados para este artigo, no entanto, argumentaram que os riscos superavam esses benefícios.
A nova análise retrospectiva de pacientes que tomam Leqembi e Aduhelm indicou que a taxa de mortalidade foi de três a quatro vezes maior do que para pacientes com Alzheimer que não tomam os medicamentos. Pouco se entende sobre outro risco potencial dos medicamentos que reduzem a amiloide: a aceleração da atrofia cerebral.
Scott Ayton, professor de neurociência na Universidade de Melbourne, estudou o fenômeno. “Os resultados chocantes que surgiram de nossa análise”, disse ele em uma entrevista, “é que esses medicamentos, em todas as classes que analisamos, não preservaram o volume cerebral; eles aceleram a aparente atrofia.”
A atrofia cerebral ocorre naturalmente com o envelhecimento, mas acontece mais rapidamente em pacientes com Alzheimer e ainda mais rápido em pacientes que usam medicamentos que reduzem a amiloide, segundo neurologistas.
A busca por uma cura continua
Mais de um século após a descoberta do Alzheimer e décadas de testes de medicamentos, a realidade sóbria é que os cientistas ainda não conseguem concordar sobre o que causa a doença, muito menos como derrotá-la. Eles não sabem qual papel a amiloide desempenha no desenvolvimento do Alzheimer ou se é o Alzheimer que causa o desenvolvimento da amiloide.
O que um número crescente de cientistas diz, no entanto, é que, embora não haja problema em continuar estudando medicamentos que reduzem a amiloide, chegou a hora de expandir o foco.
No dia em que Lane morreu, enquanto ainda estava em suporte vital, a Charter Research ligou para Holmes para lembrá-la de que sua amiga estava agendada para outra infusão.
“‘Você não está ciente de que ela está no hospital?’” Holmes lembra-se de ter dito. “‘Estamos falando sobre desligar os aparelhos.’ Eu disse, ‘Não, ela não voltará nunca.’”